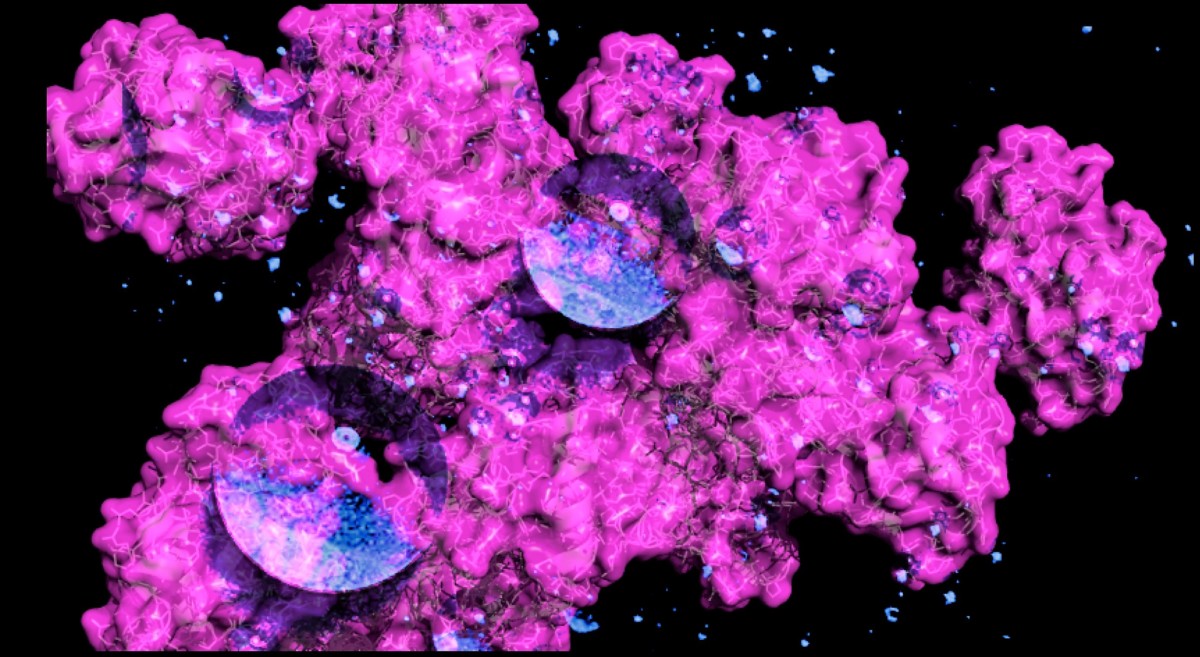
Los científicos están cada vez más cerca de observar directamente cómo y por qué el agua es esencial para la vida tal como la conocemos.
Un estudio publicado en Proceedings of the National Academy of Sciences ha ofrecido la evidencia más contundente hasta la fecha de que las proteínas (moléculas grandes y complejas que se pliegan de maneras determinadas para permitir reacciones biológicas) no pueden plegarse por sí mismas.
Por el contrario, parece ser que el trabajo de plegado se realiza por moléculas de agua, mucho más pequeñas, que rodean a las proteínas y empujan y tiran de ellas para que se pliegan de una manera determinada en fracciones de segundo, como si hubiera decenas de artistas de papiroflexia diminutos que doblan una hoja gigante de papel a velocidades impresionantemente rápidas.
Este descubrimiento, hecho por el líder del grupo de investigación en la Universidad Estatal de Ohio, Dongping Zhong, fue calificado como un «gran paso adelante» en la comprensión de las interacciones entre proteínas y agua y dijo que responde a una pregunta que ha resultado muy esquiva en la investigación sobre la dinámica de proteínas durante décadas.
«Durante mucho tiempo, los científicos han estado tratando de averiguar cómo interactúa el agua con las proteínas. Este es un problema fundamental relacionado con la estructura de la proteína, la estabilidad, la dinámica y, finalmente, la función», dijo Zhong.

«Creemos que ahora tenemos pruebas directas contundentes de cómo el agua, en escalas de tiempo ultrarrápidas (picosegundos, o billonésimas de segundo), modula las fluctuaciones proteínicas», concluye.
Zhong, profesor de física así como de química y bioquímica, y su equipo utilizaron pulsaciones de láser ultrarrápidos para tomar instantáneas de las moléculas de agua moviéndose alrededor de una ADN polimerasa, un tipo de proteína que ayuda al ADN a reproducirse.
La clave para conseguir una buena perspectiva de la interacción fue localizar con precisión una serie de sondas ópticas en la superficie de la proteína, dijo. Los investigadores insertaron moléculas de un tipo de aminoácido llamado triptófano en la proteína a modo de sonda, y observaron cómo el agua se movía alrededor suyo.
Las moléculas de agua normalmente fluyen entre sí a velocidades de picosegundos, mientras que las proteínas se pliegan a velocidades de nanosegundos, que son unas 1.000 veces más lentas. Anteriormente, el equipo de Zhong ya había demostrado que las moléculas de agua se ralentizan cuando se encuentran con una proteína. Aun así, las moléculas de agua se siguen moviendo unas 100 veces más rápido que la proteína cuando se conectan a ella.
En este estudio, los investigadores fueron capaces de observar cómo las moléculas de agua tocaban directamente las llamadas “cadenas laterales” de la proteína, que son las porciones de la molécula que se unen y desenlazan entre sí para permitir tanto el plegado como la función de la proteína. Los investigadores fueron asimismo capaces de medir el tiempo que tardaban las moléculas en realizar los movimientos.
Con esta información, realizaron simulaciones por ordenador en el Centro de Supercomputación de Ohio (OSC) que permitieron a los investigadores visualizar lo que estaba sucediendo: allí donde el agua se movía de una manera determinada, nanosegundos después se plegaba la proteína, como si fueran las moléculas de agua las que estuvieran dirigiendo la forma en que se enlazaba la proteína.
Obviamente, el agua no puede dar forma a una proteína de manera arbitraria, explicó Zhong. Las proteínas sólo se pueden plegar y desplegar de unas pocas formas diferentes, dependiendo de los aminoácidos de que estén compuestas.
«Hemos demostrado [en nuestro estudio] que la forma final de una proteína depende de dos cosas: el agua y los propios aminoácidos. Ahora podemos decir que, en escalas de tiempo ultrarrápidas, las fluctuaciones en la superficie de la proteína son controladas por fluctuaciones en el agua. Las moléculas de agua trabajan juntas como una gran red que dirige el movimiento de las proteínas».