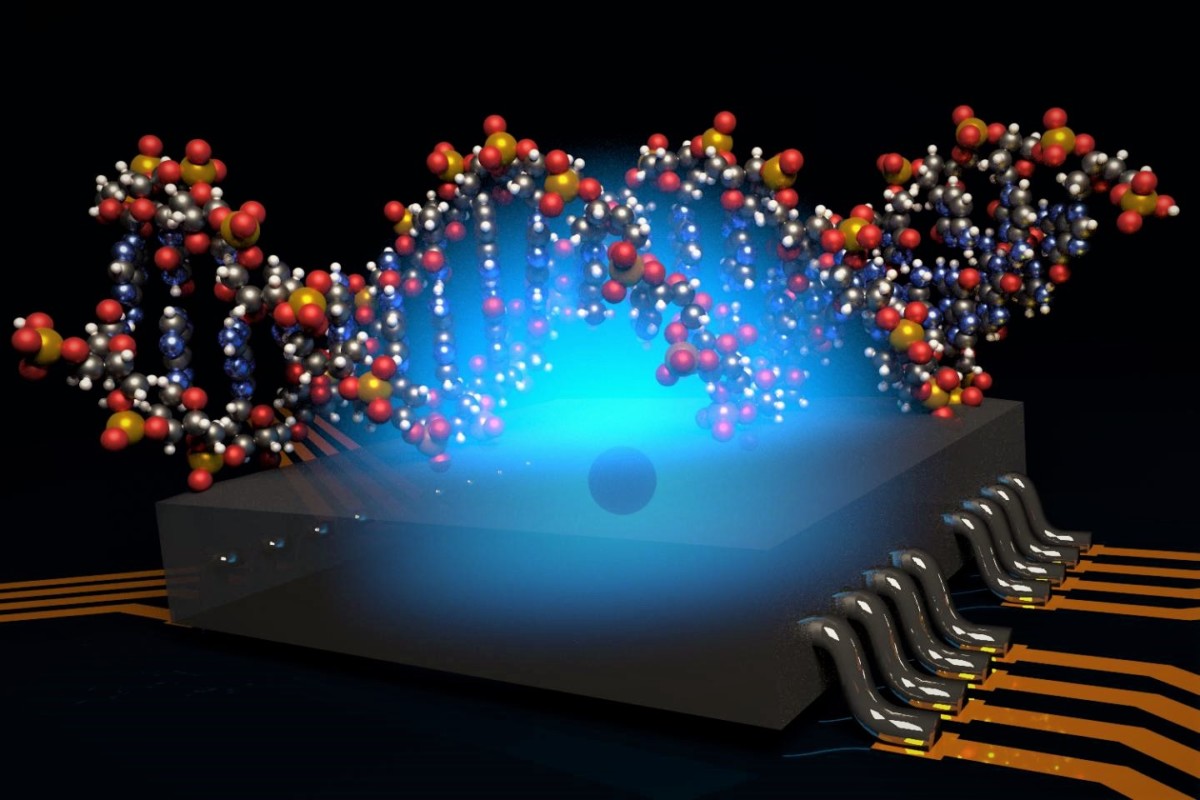
De forma similar a como una máquina convencional de resonancia magnética (IRM) utiliza grandes imanes para generar imágenes en 3D, un grupo de físicos ha desarrollado una propuesta para una máquina de nano-IRM cuántica que usaría las propiedades magnéticas de un único qubit atómico para generar imágenes 3D con una resolución de angstroms (0,1 nanómetros). La nueva técnica podría conducir al desarrollo de microscopios de una sola molécula para la obtención de imágenes de biomoléculas, con aplicaciones en el descubrimiento de fármacos y una mejor comprensión de las enfermedades.
Los investigadores, dirigidos por Lloyd Hollenberg, profesor de física en la Universidad de Melbourne, en Australia, han publicado un artículo sobre la nueva técnica en la revista científica Nature Communications.
«Los continuos avances científicos en las últimas décadas nos han permitido entender y, por lo tanto, curar, muchos problemas médicos a escala macroscópica, como las fracturas óseas o los coágulos sanguíneos», explicó el autor principal Viktor Perunicic de la Universidad de Melbourne. «Sin embargo, las enfermedades a las que se enfrenta hoy en día la humanidad son microscópicas, ya que surgen de malfuncionamientos a nivel molecular, como puede ser por ejemplo una proteína deformada en algún lugar de una célula. El cáncer, la diabetes, las infecciones virales y muchas otras tienen esto en común, pero en la actualidad casi no hay medios para ver lo que está sucediendo dentro de nuestros cuerpos a este nivel.
«En nuestro trabajo, tratamos de resolver este problema mediante la creación de un plan para desarrollar la tecnología que pueda permitir adentrarse visualmente en 3D en la estructura atómica de las moléculas individuales en su entorno celular. Lo alcanzamos mediante el aprovechamiento de la tecnología de computación cuántica en un concepto que lleva la resonancia magnética a la escala atómica».
El sistema de formación de imágenes propuesto consiste en un qubit atómico que se coloca a unos 2 nanómetros por debajo de una superficie que contiene la molécula a fotografiar. El qubit actúa como fuente y sensor de campos magnéticos, con sus propiedades magnéticas cuánticas (su espín) que interactúan con las propiedades magnéticas de los átomos en la molécula objetivo. Mediante la recolección de datos sobre estas interacciones en diversas orientaciones, el sistema podría determinar las posiciones de los átomos individuales y construir una imagen 3D de la estructura de la molécula objetivo.
Los científicos simularon la nueva técnica utilizando una molécula de rapamicina (C51H79NO13), un fármaco inmunosupresor que se utiliza comúnmente para prevenir el rechazo de trasplante de órganos. En técnicas convencionales de obtención de imágenes como la cristalografía de rayos X, es difícil detectar los átomos de hidrógeno. Pero midiendo la densidad del espín nuclear del hidrógeno, el método de la nano-IRM puede generar imágenes 3D de los átomos de hidrógeno, así como los átomos de carbono, con una resolución media de la imagen de angstroms.
«La capacidad de plasmar la estructura atómica de las moléculas en su entorno celular nativo es vital tanto para entender el origen de la enfermedad como para encontrar su cura», dijo Hollenberg. «Por ejemplo, en la búsqueda y las pruebas de nuevos fármacos uno primero identificaría un blanco, a menudo una proteína de membrana. El escaneo de la verdadera estructura de la proteína en el ambiente celular es esencial para entender cómo interactuarán con ella las moléculas del fármaco. Con esta información, se podría seleccionar o diseñar un tipo de molécula de fármaco. Además, el mismo dispositivo escaneo podría proporcionar los medios para comprender y comprobar la eficacia del fármaco observando sus interacciones con la molécula objetivo a nivel atómico. Nuestro objetivo es desarrollar una tecnología versátil para observar la estructura atómica bioquímica actualmente inaccesible de moléculas importantes in situ, de manera análoga a cómo las máquinas de resonancia magnética hospitalaria observan la anatomía de nuestros cuerpos».
Debido a la gran cantidad de datos involucrados, las simulaciones muestran que el tiempo total para generar una imagen de la molécula de rapamicina es, hoy por hoy, de aproximadamente 175 horas. Sin embargo, los investigadores esperan que las mejoras futuras reduzcan en gran medida este tiempo y aumenten aún más la resolución. En el futuro, también planean ampliar el diseño del sistema para obtener imágenes de biomoléculas más grandes.
«Hasta ahora nuestro trabajo se ha centrado en el fundamento teórico fundamental; en la comprensión de cómo construir físicamente el dispositivo con la tecnología disponible actualmente», dijo Perunicic. «Estamos desarrollando el intrincado control cuántico mecánico que proporcione la capacidad de escanear moléculas individuales, y también estamos realizando simulaciones para probar el rendimiento en condiciones realistas. Puesto que los resultados de estas investigaciones fueron alentadores, la dirección natural para el próximo par de años es indagar en demostraciones experimentales de la prueba de concepto».
Artículo original publicado por Phys. Revisado y traducido por ¡QFC!